BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA
Berinert 500 NE por és oldószer oldatos injekcióhoz vagy infúzióhoz
C1-észteráz-inhibitor, humán
Mielőtt beadják Önnek ezt az injekciót, olvassa el figyelmesen az alábbi betegtájékoztatót.
- Tartsa meg a betegtájékoztatót, mert a benne szereplő információkra a későbbiekben is szüksége lehet.
- Ezt a gyógyszert az orvos Önnek írta fel. Ne adja át a készítményt másnak, mert számára ártalmas lehet még abban az esetben is, ha tünetei az Önéhez hasonlóak.
- További kérdéseivel forduljon kezelőorvosához vagy gyógyszerészéhez.
- Ha bármely mellékhatás súlyossá válik, vagy ha a betegtájékoztatóban felsorolt mellékhatásokon kívül egyéb tünetet észlel, kérjük, értesítse orvosát vagy gyógyszerészét.
A betegtájékoztató tartalma:
- Milyen típusú gyógyszer a Berinert 500 NE injekció és milyen betegségek esetén alkalmazható?
- Tudnivalók a Berinert 500 NE injekció alkalmazása előtt
- Hogyan kell alkalmazni a Berinert 500 NE injekciót?
- Lehetséges mellékhatások
- Hogyan kell a Berinert 500 NE injekciót tárolni?
- További információk
- Milyen típusú gyógyszer a Berinert 500 NE injekció és milyen betegségek esetén alkalmazható?
Mi a Berinert 500 NE?
A Berinert 500 NE (Nemzetközi Egység) por és oldószer. A kész oldat injekcióként vagy infúzióként vénába adható.
A Berinert 500 NE injekciót emberi plazmából (a vér folyékony része) állítják elő, aktív hatóanyaga az emberi (humán) C1–észteráz‑inhibitor fehérje.
Mire alkalmazható a Berinert 500 NE injekció?
A Berinert 500 NE injekció I-es és II-es típusú örökletes (herediter) angioödéma (HAE, ödéma = vizenyős duzzanat) kezelésére és gyógyászati beavatkozás előtt a megelőzésére alkalmazható. A herediter angioödéma (HAE) az érrendszer örökletes betegsége. Nem allergiás eredetű. A HAE oka a C1‑észteráz–inhibitor fehérje kialakulásának elégtelensége, hiánya, vagy károsodása. A betegség az alábbi tünetekkel jellemezhető:
– a kezeken és a lábakon hirtelen kialakuló vizenyős duzzanat,
– az arcon hirtelen kialakuló vizenyős duzzanat feszülő érzéssel,
– szemhéj-, ajakduzzanat, lehetséges gégevizenyő, ami nehézlégzést okoz,
– nyelvduzzanat,
– görcsös fájdalom a has területén.
Általában a test minden részén kialakulhat.
- Tudnivalók a Berinert 500 NE injekció alkalmazása előtt
Az ebben a részben szereplő információkat az Ön kezelőorvosának figyelembe kell vennie, mielőtt Ön Berinert 500 NE injekciót kapna.
Ne alkalmazza a Berinert 500 NE injekciót
- Ha Ön túlérzékeny (allergiás) a C1‑észteráz‑inhibitor fehérjére vagy a Berinert 500 NE injekció bármely egyéb összetevőjére (lásd 6. pont „További információk”)
Amennyiben Ön bármilyen gyógyszerre vagy élelmiszerre allergiás, tájékoztassa kezelőorvosát vagy gyógyszerészét.
Figyelmeztetések és óvintézkedések:
- Ha a Berinert 500 NE injekció korábban már okozott Önnek allergiás reakció Megelőzésképpen Önnek antihisztamint és kortikoszteroidot kell kapnia, ha kezelőorvosa javasolta.
- Amikor allergiás vagy anafilaxiás reakció (súlyos allergiás reakció, amely légzési nehézséget vagy szédülést okoz) alakul ki. A Berinert 500 NE injekció alkalmazását azonnal be kell fejezni (az infúziót meg kell szakítani).
- Ha Ön gégeödémában szenved. Önt gondosan ellenőrizni kell, felkészülve az intenzív kezelésre.
- Az elfogadott indikáción és alkalmazáson túl, ún. off-label kezelésben (úm. áteresztő kapilláris szindróma [Capillary Leak Syndrome; CLS]) Lásd 4. pont „Lehetséges mellékhatások”
Az Ön kezelőorvosa gondosan mérlegelni fogja a Berinert‑kezelés előnyeit, összehasonlítva a lehetséges komplikációk kockázatával.
Vírusbiztonság
Az emberi vérből vagy plazmából előállított készítmények gyártásánál szigorú rendszabályokat alkalmaznak, hogy a fertőzések átvitelét megakadályozzák. Ezek az alábbiak:
- A vért, illetve plazmát adó donorok gondos kiválasztása, amivel kizárják a fertőzés átvitelének kockázatát, és
- minden egyes plazmaadományt és plazmakeveréket ellenőriznek vírusok, illetve egyéb fertőző ágensek jelenlétére.
A gyártók a vér vagy plazma feldolgozási folyamatában vírusinaktiváló vagy víruseltávolító lépéseket alkalmaznak. Ennek ellenére az emberi vérből vagy plazmából előállított gyógyszerek alkalmazása esetén nem zárható ki teljesen fertőző ágensek átvitele. Ez vonatkozik ismeretlen vagy újonnan felbukkanó vírusokra és egyéb típusú fertőzésekre.
Az alkalmazott módszerek hatékonyak a burokkal rendelkező vírusoknál, például humán immundeficiencia vírus (HIV, az AIDS vírusa), hepatitisz B‑vírus és hepatitisz C‑vírus (májgyulladás) és a burokkal nem rendelkező vírusoknál, mint a hepatitisz A vírus (májgyulladás) és a parvovírus B19.
Amennyiben Ön rendszeresen vagy ismétlődően kap emberi plazmából előállított termékeket, kezelőorvosa azt javasolhatja Önnek, hogy fontolja meg a hepatitisz A és B elleni védőoltás beadatását.
Kifejezetten javasolt, hogy minden alkalommal, amikor a Berinert 500 NE injekció beadásra kerül, fel kell jegyezni a beadás dátumát, a készítmény gyártási számát és a beadott injekció térfogatát.
Egyéb gyógyszerek és a Berinert
- Mindig tájékoztassa kezelőorvosát vagy gyógyszerészét az Ön által folyamatosan vagy a kezelést megelőzően szedett minden gyógyszerről. Ez vonatkozik a recept nélkül kapható készítményekre is.
- Berinert 500 Egység injekció nem keverhető egyéb gyógyszerrel és oldószerrel a fecskendőben vagy az infúziós készletben.
Terhesség és szoptatás
- Amennyiben Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, a gyógyszer alkalmazása előtt beszéljen kezelőorvosával vagy gyógyszerészével.
- Terhesség és szoptatás alatt a Berinert 500 NE injekció csak indokolt esetben alkalmazható.
A készítmény hatásai a gépjárművezetéshez és gépek kezeléséhez szükséges képességekre
Nem vizsgálták a készítmény hatását a gépjárművezetéshez és gépek kezeléséhez szükséges képességekre.
A Berinert 500 NE injekció nátriumot tartalmaz
A Berinert 500 NE injekció 486 mg nátriumot (kb. 21 mmol) tartalmaz 100 milliliter oldatban. Amennyiben Ön sószegény diétát alkalmaz, kérjük, ezt vegye figyelembe.
- Hogyan kell alkalmazni a Berinert 500 NE injekciót?
A kezelését a C1-észteráz-inhibitor‑hiány kezelésében jártas orvos felügyelete mellett kell elkezdeni.
Adagolás
Felnőttek
Akut angioödéma‑roham kezelésére:
20 NE testtömeg‑kilogrammonként (20 NE/ttkg)
Gyógyászati beavatkozás előtt az akut angioödéma‑roham megelőzésére:
1000 NE 6 órán belül a gyógyászati, fogászati vagy sebészeti beavatkozás előtt.
Gyermekek
Akut angioödéma‑roham kezelésére:
20 NE testtömeg‑kilogrammonként (20 NE/ttkg)
Gyógyászati beavatkozás előtt az akut angioödéma roham megelőzésére:
15-30 NE testtömeg‑kilogrammonként (15-30 NE/ttkg) 6 órán belül a gyógyászati, fogászati vagy sebészeti beavatkozás előtt. Az adag megválasztásánál figyelembe kell venni a klinikai körülményeket, úm. a beavatkozás típusa és a betegség súlyossága.
Ha az előírtnál több Berinert 500 NE injekciót alkalmazott
Túladagolásról szóló esetet nem jelentettek.
Feloldás és az alkalmazás módja
A Berinert 500 NE injekciót rendszerint vénába adja (intravénás) az Ön kezelőorvosa vagy a nővér. Ön vagy az Ön gondozója is beadhatja a Berinert 500 NE injekciót, de csak megfelelő felkészítés után. Ha az Ön kezelőorvosa úgy találja, hogy Ön alkalmas lehet az otthoni kezelésre, részletes oktatást fog Önnek tartani. Önnek egy naplót kell vezetnie, amelyben az otthoni kezelést dokumentálja, és ezt a naplót minden esetben magával kell vinnie kezelőorvosához. Ön vagy a gondozója beadási technikáját rendszeresen ellenőrizni fogják, ami biztosítja a folyamatos, megfelelő kezelést.
Általános teendők
- A por feloldását és az oldat felszívását az injekciós üvegből aszeptikus körülmények között kell elvégezni. Alkalmazza a termékhez mellékelt fecskendőt.
- Az elkészített oldat színtelen és tiszta. Szűrés vagy a felszívás után (lásd alább), beadás előtt az oldatot megtekintéssel ellenőrizni kell színváltozásra és apró részecskék jelenlétére.
- Ne használja az oldatot, ha láthatóan zavaros vagy pelyheket, részecskéket tartalmaz.
- A fel nem használt készítmény, illetve hulladékanyag megsemmisítését a helyi előírások szerint és az Ön kezelőorvosának instrukcióinak megfelelően kell végrehajtani.
Visszaoldás
A Berinert 500 NE injekció port és oldószert tartalmazó üvegeit bontatlanul melegítse szobahőmérsékletre. Ezt megteheti úgy, hogy az üvegeket szobahőmérsékletre helyezi kb. 1 órára, vagy néhány percig a kezében tartja. Ne melegítse közvetlenül az üvegeket. Az üvegeket nem szabad testhőmérséklet (37°C) fölé melegíteni.
A készítményt és az oldószert tartalmazó injekciós üvegek védőkupakját óvatosan távolítsa el. Mindkét injekciós üveg gumidugóját tisztítsa meg egy-egy alkoholos törlővel, és hagyja megszáradni. Az oldószer most már áttölthető a port tartalmazó üvegbe a mellékelt álltöltő készlet (Mix2Vial) segítségével. Kövesse az alábbi utasítást.
Felszívás és alkalmazás
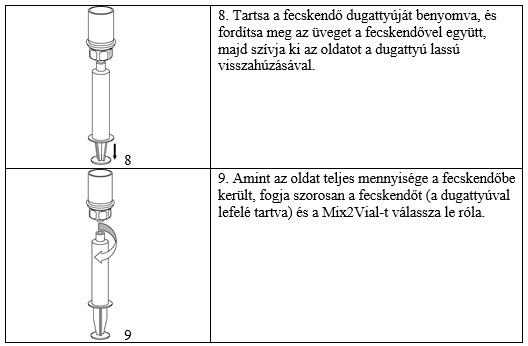
Alkalmazás
Az oldatot intravénás injekcióként vagy infúzióként, lassan kell beadni (4 ml/perc).
- Lehetséges mellékhatások
Mint minden gyógyszernek a Berinert 500 NE injekciónak is lehetnek mellékhatásai, habár nem mindenkinél jelentkezik.
Kérjük, haladéktalanul vegye fel a kapcsolatot kezelőorvosával:
- ha bármely mellékhatás előfordul, vagy
- ha Ön olyan mellékhatásokat észlel, ami nem szerepel ebben a tájékoztatóban.
A Berinert 500 NE injekcióhoz köthető nemkívánatos hatások ritkák.
Az alábbi mellékhatásokat ritkán észlelték (10 000 kezelt betegből több mint 1, de 1000 kezelt betegből kevesebb mint 1 esetén észlelhető):
- Áteresztő kapilláris szindróma (Capillary Leak Syndrome; a kis vérerekből kifolyó folyadék a szövetekben gyülemlik fel) megelőző vagy terápiás kezelésekor a fokozott véralvadék‑képződés kockázata áll fenn szívműtét közben vagy után a külső keringetés alatt (lásd 2. pont „A Berinert 500 NE injekció fokozott elővigyázatossággal alkalmazható”).
- Testhőmérséklet‑emelkedés, valamint égő és csípő érzés a beadás helyén.
- Túlérzékenységi vagy allergiás reakciók (például szabálytalan szívverés, szaporább szívverés, vérnyomásesés, bőrpír, kiütések, nehézlégzés, fejfájás, szédülés, émelygés).
Nagyon ritkán előfordulhatnak (10 000 kezelt betegből kevesebb mint 1 esetén, beleértve az egyedi eseteket, észlelhető) olyan túlérzékenységi reakciók, melyek egészen sokk állapotáig súlyosbodnak.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy gyógyszerészét. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az V. függelékben található elérhetőségeken keresztül. A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
- Hogyan kell a Berinert 500 NE injekciót tárolni?
- A gyógyszer gyermekektől elzárva tartandó!
- A címkén és a dobozon feltüntetett lejárati idő (Felhasználható:) után ne alkalmazza a Berinert 500 NE injekciót.
- Legfeljebb 30°C-on tárolandó.
- Nem fagyasztható.
- A fénytől való védelem érdekében az injekciós üvegek a külső csomagolásban tárolandók.
- A Berinert 500 NE injekció nem tartalmaz konzerváló szert, ezért feloldás után azonnal fel kell használni.
- Amennyiben az elkészített oldatot nem adják be azonnal, 8 órán belül szabad felhasználni és csak az injekciós üvegben szabad tárolni.
- A csomagolás tartalma és egyéb információk
Mit tartalmaz a Berinert 500 NE injekció
A készítmény hatóanyaga:
C1-észteráz-inhibitor, emberi (500 NE/injekciós üveg; feloldás után 50 NE/ml)
További információkért lásd a „Az alábbi információk kizárólag orvosoknak vagy más egészségügyi szakembereknek szólnak” fejezetet.
Egyéb összetevők:
Glicin, nátrium-klorid, nátrium-citrát.
Lásd a 2. pont utolsó bekezdését „Fontos információk a Berinert 500 NE injekció egyes összetevőiről”
Oldószer: injekcióhoz való víz.
Milyen a Berinert 500 NE injekció készítmény külleme és mit tartalmaz a csomagolás
A Berinert 500 NE fehér port és az oldáshoz szükséges injekcióhoz való vizet tartalmaz. Az elkészített oldat színtelen és tiszta.
Kiszerelés
500 NE-t tartalmazó doboz:
1 db injekciós üveg porral (500 NE)
1 db injekciós üveg 10 ml injekcióhoz való vízzel
1 db szűrővel ellátott áttöltő eszköz 20/20
Elkészítéshez és beadáshoz szükséges készlet (egy belső dobozban):
1 db 10 ml-es egyszer használatos fecskendő
1 db vénapunkcióra szolgáló készlet
2 db alkoholos törlő
1 db nem steril tapasz
A forgalomba hozatali engedély jogosultja és a gyártó
CSL Behring GmbH
Emil-von-Behring-Str. 76
35041 Marburg
Németország
Ezt a gyógyszert az Európai Gazdasági Térség tagállamaiban az alábbi neveken engedélyezték:
| Gyógyszer neve | Ország |
| Berinert 500 IE Pulver und Lösungsmittel zur Herstellung einer Injektions – oder Infusionslösung | Ausztria |
| Berinert 500 | Belgium, Ciprus, Németország, Görögország, Luxemburg, Lengyelország |
| Berinert 500, 500 IU Powder and solvent
for solution for injection/infusion |
Bulgária |
| Berinert | Dánia, Olaszország, Portugália, |
| Berinert 500 IU, injektio/infuusiokuiva-aine
ja liuotin, liuosta varten |
Finnország |
| Berinert 500 IU | Csehország, Szlovákia, |
| Berinert 500 IU, poudre et solvant pour solution injectale/perfusion | Franciaország |
| Berinert 500 NE por és oldószer oldatos injekcióhoz vagy infúzióhoz | Magyarország |
| Berinert 500 IU pulver og væske til
injeksjons-/infusjonsvæske, oppløsning |
Norvégia |
| Berinert 500 UI, pulbere şi solvent pentru soluţie injectabilă/perfuzabilă | Románia |
| Berinert 500 i.e. prasek in vehikel za raztopino za injiciranje/infundiranje | Szlovénia |
| Berinert 500 UI Polvo para solución
inyectable y para perfusión |
Spanyolország, |
| Berinert 500 IE, pulver och vätska till
injektions-/infusionsvätska, lösning |
Svédország |
| Berinert 500 IU powder and solvent for solution for injection/infusion | Egyesült Királyság |
A betegtájékoztató legutóbbi felülvizsgálatának dátuma: 2019. január
